
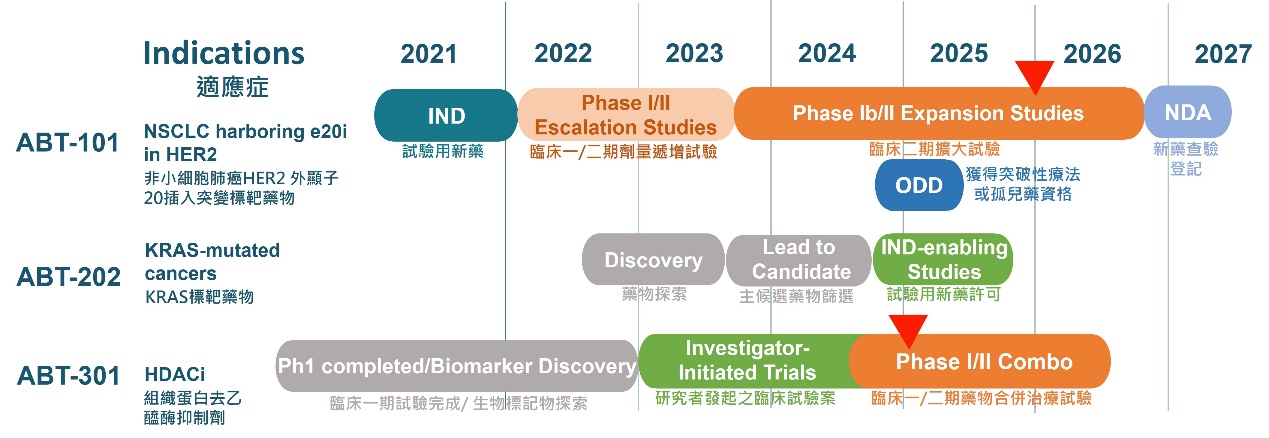
專注於新一代精準醫療癌症醫藥開發的安邦生技,上個月在國家生技研究園區舉辦實驗室開幕剪綵,包括前副總統陳建仁博士與國衛院梁賡義院長等多位重量級貴賓,出席剪綵儀式。安邦也同時宣布,旗下產品ABT-101已經獲得美國食品藥物管理局(FDA)核准進行Phase Ib/II臨床試驗,適應症狀為HER2 Exon20基因突變引發的非小細胞肺癌(NSCLC),而旗下ABT-301也已完成一期臨床試驗,成為甫成立就有兩項進入二期臨床試驗階段的新創生技公司。
安邦是專注於研發精準醫療抗癌藥物的新藥研發公司,除了ABT-101以外,ABT-301則具有治療多種固態腫瘤的潛力。此外,安邦正在進行的抗癌藥物研發計畫,對抗因KRAS或TP53等基因變異引發的難治癌症,近期可望進入臨床前發展階段。
經營團隊具備多年新藥開發經驗
今(2022)年四月,人類基因圖譜已經解碼完成,醫藥研發也進入以變異基因為開發標靶的精準醫療時代。不過,許多變異基因標靶仍無對應藥物,成為各大醫藥公司競相研發的標的。全球進入精準醫療時代,安邦即為針對特定變異基因,開發精準癌症醫療療法的新藥研發公司。
安邦許多高階主管都具有國內外開發新藥經驗,也創下成功上市紀錄,可說是台灣生技產業「經驗最豐富的新創公司」。安邦創辦人為具有成功研發小分子抗癌新藥的化學專家石全博士,以及謝興邦博士。
石全博士任職禮來藥廠期間,曾主導研發罕病「惡性肋膜間皮癌」藥物「愛寧達(Alimta)」。此外,他參與研發的藥物Vebreltinib也已經完成二期臨床試驗,也可望在2023年獲得美國FDA的上市許可,成為他主要參與研發的第二個上市新藥。
Vebreltinib屬於新藥研發公司Apollomics(冠科美博)旗下產品,可治療因cMet引起的非小細胞肺癌以及其他實體腫瘤。Apollomics甫於今年九月中宣布,將與創投基金Maxpro Capital合併,在美國納斯達克掛牌。
謝興邦博士則具有豐富的抗癌、抗病毒及糖尿病新藥研發經驗,已經研發出進入臨床試驗階段的三個全新化合物,曾擔任國家衛生研究院(國衛院)學術研究處處長、生技與藥物研究所副所長,以及中研院生醫轉譯研究中心副主任等職務。
▲安邦生技產品線
針對特定基因變異 研發精準抗癌新藥
由於安邦從創辦人到高階主管,包括共同創辦人謝興邦博士、執行長徐祖安博士,以及總經理薛博仁等人,都曾在國衛院進行新藥研發,前副總統陳建仁還特地在百忙之中,與國衛院院長梁賡義博士,聯袂為安邦開幕剪綵站台。
安邦創立是以謝興邦與徐祖安兩人起頭,因此以兩人姓名為公司命名。之後,行動基因共同創辦人薛博仁,則在看好公司前景下,受邀加入安邦,擔任總經理一職。
此外,安邦也網羅了羅浚晅醫師擔任策略長,規劃藥物從臨床試驗到藥物上市的重要市場進入策略,以及ESG相關事務,還有曾擔任台灣諾華公司醫學顧問等職務,嫻熟腫瘤與臨床試驗相關事宜,具有十多年經驗的代理醫務長謝志逸醫師,希望結合台灣優秀的研發人才,以成為全球頂尖精準癌症藥物研發公司為目標。
國際癌症治療已經進入精準醫療時代。隨著次世代基因篩檢技術日益普及,找出病患致癌基因,再對症下藥,除了可提高治癒率,且同一變異基因,可能導致多種癌症,若能找到合適標的,將可適用多種適應症,而透過基因篩選,也可找出合適病患,提高臨床試驗成功率。然而,受新藥研發速度侷限,病患可選擇的藥物仍相當有限。
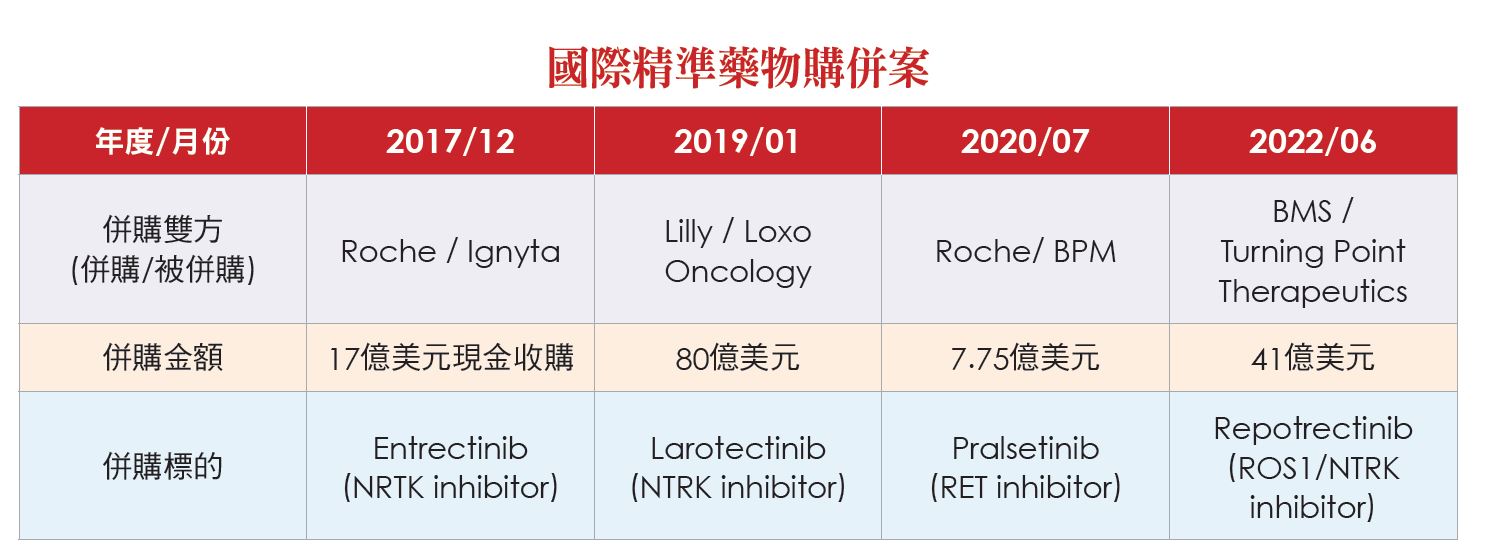
各大藥廠與生技公司紛紛投入研發或併購精準醫療藥物,從2017年起,羅氏、禮來與必治妥施貴寶(Bristol-Myers Squibb,簡稱BMS),紛紛投下重金,進行購併,取得精準醫療藥物(請見附表)。安邦即為針對特定基因變異,研發精準抗癌新藥的新藥研發公司。
基因檢測協助病患對症下藥
安邦目前旗下已取得IND,將進入臨床階段的產品,包括ABT-101與ABT-301。ABT-101是一種酪胺酸激酶抑制劑(Tyrosine Kinase Inhibitor, TKI)。研究顯示,酪胺酸激酶突變是引發癌症的原因,因此TKI成為新型抗癌藥物的研發標的。安邦將以ABT-101進行治療NSCLC的臨床試驗。
據了解,全球每年新增二百萬名NSCLC病患。根據衛福部國民健康署統計,台灣肺癌死亡率高居十大癌症之首,每年新增超過一萬名肺癌患者,其中高達85%為NSCLC病患。根據研究,NSCLC發生與其驅動基因突變(driver mutations)具有緊密的關聯性,透過基因檢測可以協助病患對症下藥,提高治療成功率。
ABT-101可針對酪胺酸激酶(TKI)的HER2 EX20i基因變異引發的癌症進行治療,約佔整體病患3%左右。由於這類病患尚未有理想療法,因此,很快獲得美國FDA的Phase Ib/II的臨床試驗許可,安邦將儘速與臨床試驗合作夥伴合作,透過變異基因篩檢出候選病患,進行臨床試驗。
未來也將根據ABT-101臨床試驗Ib/II期結果,爭取突破性治療認定(Breakthrough Therapy Designation, BTD),取得快速審核(Accelerated Approval)。
根據第一期試驗結果,ABT-101的安全性極高,在第一個二期臨床試驗啟動後,安邦生技並規劃透過執行ABT-101籃式臨床試驗(Basket trial)擴大新的適應症開發。
持續開發突破性藥物及療法
另一項已經完成一期臨床試驗的抗癌藥物ABT-301,則是小分子廣泛性組織蛋白去乙醯酶(HDAC)抑制劑。針對二十三位實體腫瘤病患的臨床一期試驗顯示,ABT-301具有良好的安全性與耐受性,無論是藥物動力學(PK)、藥效學(PD)數據方面,相較於競爭藥物,都極具競爭力。安邦正規劃推動將ABT-301治療精準化,準備進入第二期臨床試驗。
安邦執行長徐祖安博士認為,隨著基因體科學的進展,以及基因檢測日漸普及,醫學已經擺脫過去盲人摸象的時代,可精準找到病灶,可惜藥物研發仍跟不上進展,存在巨大落差。安邦生技的目標是把目前已知失落的拼圖補齊,持續為病患帶來突破性的藥物或療法,未來可以成為像美國安進,瑞士羅氏、諾華一樣的頂尖醫藥公司。

【延伸閱讀】



